近日,四川大学冯小明教授课题组结合手性双氮氧(L-PiPr3)-Ni(II)配合物催化剂和Ag2O,成功实现了茚酮甲酰胺、酯与富电子烯烃的催化不对称自由基-偶极交叉反应。羰基a位对醛、酮的不对称亲核加成反应在过去几十年被广泛研究。文献报道通过单电子氧化可以实现羰基a位的极性反转,生成亲电型的a-碳自由基,这极大丰富了羰基化学在有机合成中的应用。然而,由于自由基的反应活性高,副反应多,背景反应强等特点,实现高对映选择性不对称催化反应仍具有很大挑战。尽管目前已经发展了一些创造性的催化模式和策略来促进羰基a-碳自由基参与催化不对称反应,但存在催化剂的用量高,催化模式单一,底物的普适性不好,反应结果差等缺点。在本文中,他们利用课题组发展的手性[Ni-L-PiPr3]*配合物作为手性Lewis酸催化剂,高收率、高对映选择性的实现了不对称自由基-偶极交叉反应。各类烯烃和茚酮甲酰胺经历自由基加成、环化反应得到一系列螺环亚胺内脂以及螺环内脂类化合物。同时,根据所使用的富电子烯烃的不同,可以利用同一催化体系得到手性烯烃、醛、酮、醇四种不同类型的产物。在机理研究上,利用TEMPO捕获到了自由基中间体,并且通过自由基钟与EPR实验证明了自由基机理的合理性。
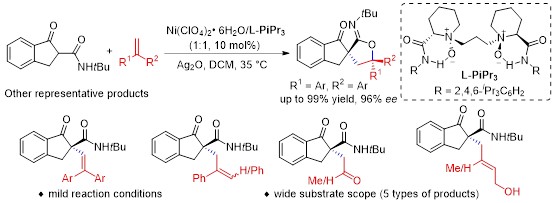
图1:手性双氮氧-Ni(II)配合物催化的不对称自由基-偶极交叉反应
以上研究结果以论文形式发表在国际期刊Angewandte Chemie International Edition上,论文题目为“Enantioselective Radical-Polar Crossover Reactions of Indanonecarboxamides with Alkenes”。四川大学博士张皙颖为本论文的第一作者,四川大学为本文的第一作者单位和通讯作者单位。该项研究工作得到了国家自然科学基金的经费支持。
原文链接:https://onlinelibrary.wiley.com/doi/10.1002/anie.201914151
