[3,3]-重排由于具有较高的化学、区域、立体选择性,在有机合成中应用广泛。相比之下,[1,3]-重排的发展却并不成熟。一般情况下,热促[1,3]-重排需要苛刻的反应条件。后续研究发现,在过渡金属催化剂,亲核催化剂或Lewis酸催化剂的存在下,可以通过两性离子中间体的过渡态,在相对温和的条件下进行该类重排。其中,Lewis酸催化是最为常见的催化方式。然而,手性Lewis酸催化的不对称[1,3]-重排却鲜有报道。主要存在以下三个挑战1) 热促[1,3]-重排导致的背景反应难以克服;2) Lewis酸催化下,烯丙基乙烯基醚类底物存在[1,3]和[3,3]-重排的区域选择性,一般难以控制;3) 要求手性Lewis酸催化剂能有效作用于中间体从而在重排过程中提供手性控制。铑盐可以促进三氮唑与苄醇衍生物的串联插入/重排反应,为α-氨基酮类化合物的高效合成提供新途径。鉴于手性α-氨基酮骨架广泛存在于天然产物和药物分子,在2018年双金属接力催化三氮唑与烯丙醇类底物的串联插入/不对称[3,3]-重排(Angew. Chem. Int. Ed. 2018, 57, 16554)工作的基础上,我们开展了三氮唑与苄醇类底物参与的不对称[1,3]-重排反应研究。研究发现,铑催化剂不但参与苄醇的O-H插入,还能促进第二步重排反应,这给该串联反应的手性控制增加了难度。但通过控制实验发现,在较低的温度(90度)下,热促以及铑盐促进的[1,3]-重排背景反应被抑制,而在此温度下手性Lewis酸催化剂却能有效催化后续的重排过程。
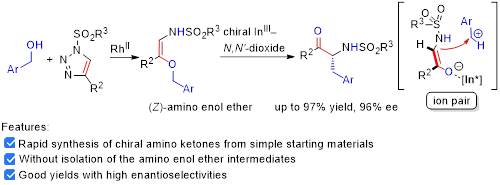
图一 双金属接力催化三氮唑与苯甲醇的串联插入/[1,3]-重排
在非手性铑盐和手性双氮氧-铟配合物存在下,不同取代的三氮唑可与多种类型的苯甲醇类底物发生反应,较高收率和高对映选择性地得到一系列a-氨基酮产物,最优结果高达97%的收率和96%的对映选择性。通过产物单晶、控制实验以及动力学研究,我们认为该重排反应经历了离子对机理。
该研究成果发表在《Angew. Chem. Int. Ed.》上,题目为“Tandem Insertion/[1,3]-Rearrangement: Highly Enantioselective Construction of α-Aminoketones”,文章链接为http://dx.doi.org/10.1002/anie.201914645。第一作者:陈煜双,通讯作者为冯小明教授、董顺喜教授。
